Introduction to major research activities
Otolaryngology/Head and Neck Surgery

Research representative
Specially Appointed Director of Otolaryngology and Head and Neck Surgery
KANEMARU Shinichi

Research representative
KANAI Rie
- Research Theme
- Identification of tissue stem/progenitor cells that can be used for tympanic membrane regeneration
Development of new tympanoplasty techniques using tympanic membrane regeneration and development of soft tissue regeneration therapy for the ear canal
- Research goal
The world's first tympanic membrane regeneration therapy, developed at our hospital, became covered by health insurance in November 2019, along with the world's first tympanic membrane regeneration treatment, Retympa®. This means that minimally invasive regeneration therapy for simple tympanic membrane perforations is now available not only at Kitano Hospital but also at hospitals and clinics nationwide. Furthermore, clinical trials are planned in the United States and Europe to establish this treatment as a global standard of regenerative medicine originating in Japan. Meanwhile, patients with severe tympanic membrane perforations, such as those caused by chronic otitis media, require traditional, more invasive tympanoplasty. In response, we are developing a new, minimally invasive endoscopic tympanoplasty technique that applies tympanic membrane regeneration therapy, as well as conducting clinical trials of regenerative therapy for the soft tissues of the external auditory canal connected to the tympanic membrane. Furthermore, tympanic membrane regeneration therapy can regenerate tympanic membrane tissue without the need for cell transplantation by inducing cells from the margins of tympanic membrane perforations. By elucidating the localization and dynamics of progenitor cells, which are the source of tympanic membrane regeneration, we aim to efficiently induce cells and improve the success rate of tympanic membrane regeneration therapy.
- Research content
Eardrum regeneration therapy
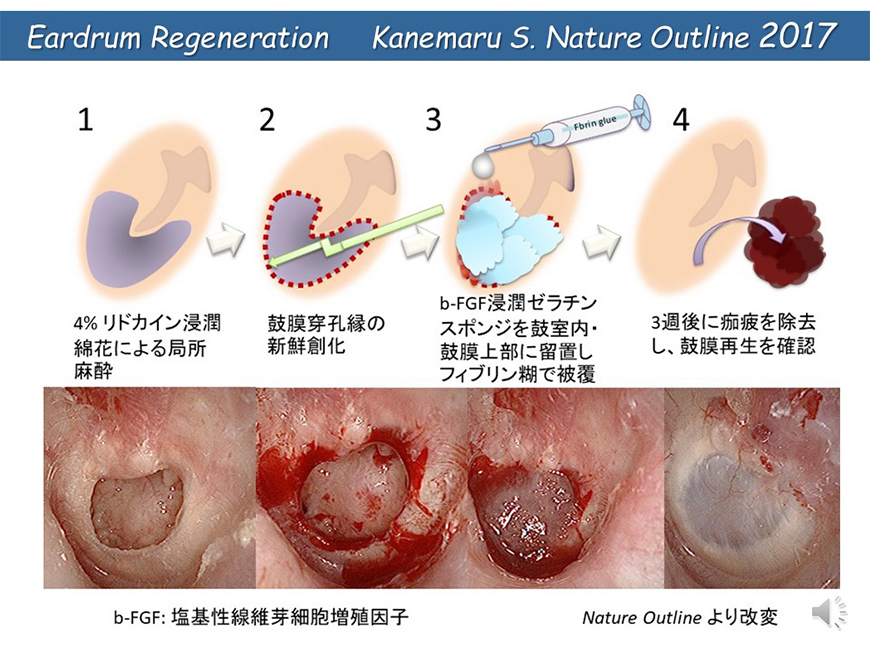
- ear canal regeneration
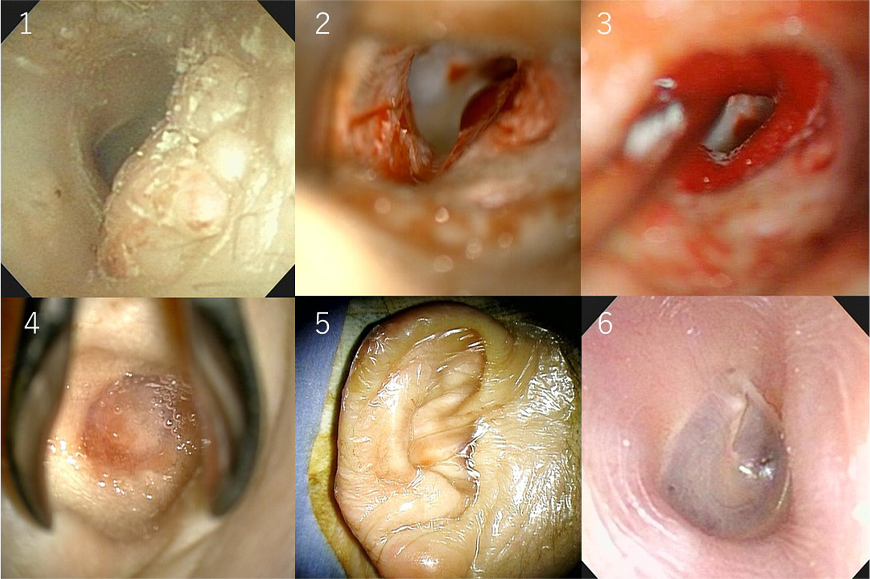
1. Benign tumor that developed in the ear canal. 2. Removal of the ear canal tumor. 3. Covering the soft tissue defect with a gelatin sponge soaked in FGF (basic fibroblast growth factor) and filling the ear canal. 4. Coating the surface of the gelatin sponge with fibrin glue. 5. Sealing the pinna with a medical dressing. The dressing and gelatin sponge are removed three weeks after surgery. 6. Six months later, the ear canal and eardrum are regenerated.
Until now, the only treatment available for extensive exposure of the bone tissue of the ear canal after cholesteatoma or ear canal tumor resection, or even after tympanoplasty, was highly invasive surgery using autologous tissue transplantation. Similar to tympanic membrane regeneration, regeneration of soft tissue in the ear canal is a treatment that uses tissue engineering techniques to regenerate normal tissue, and this treatment also uses Retympa®. A physician-initiated multi-center clinical trial is planned, and research is underway with the aim of obtaining health insurance coverage.
- Research Theme
- Elucidation of cellular dynamics during the closure of mouse tympanic membrane perforation
- Research goal
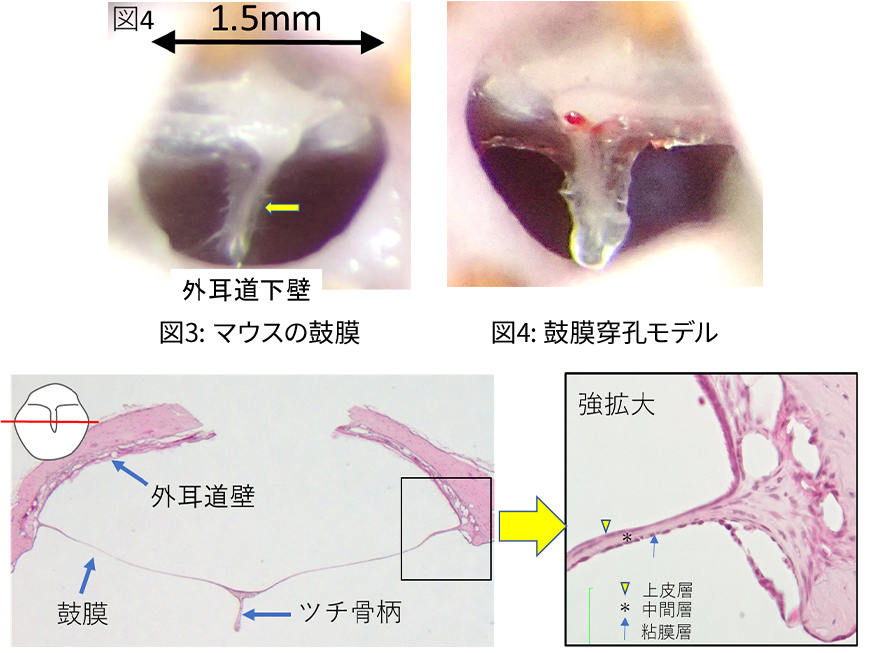
The human eardrum has a three-layer structure: an epithelial layer (mainly epithelial cells), an intermediate layer (mainly fibrous tissue), and a mucosal layer. The mouse eardrum also has a similar three-layer structure (Figure 5: High magnification).
We aim to investigate the cell dynamics during the process of perforation closure in a mouse model of tympanic membrane perforation, and to elucidate the mechanism of cell induction that occurs during fresh wound healing. We are particularly interested in the cell dynamics of the middle layer, which is important for maintaining the shape and strength of the tympanic membrane.
- Research content
We are using immunohistological techniques to evaluate the time course of changes in perforated mouse eardrums. We are evaluating differences in cell dynamics between the intermediate layer and epithelial layer, as well as the localization and dynamics of highly proliferative Ki67+ cells.
Time course of closure of mouse tympanic membrane perforation
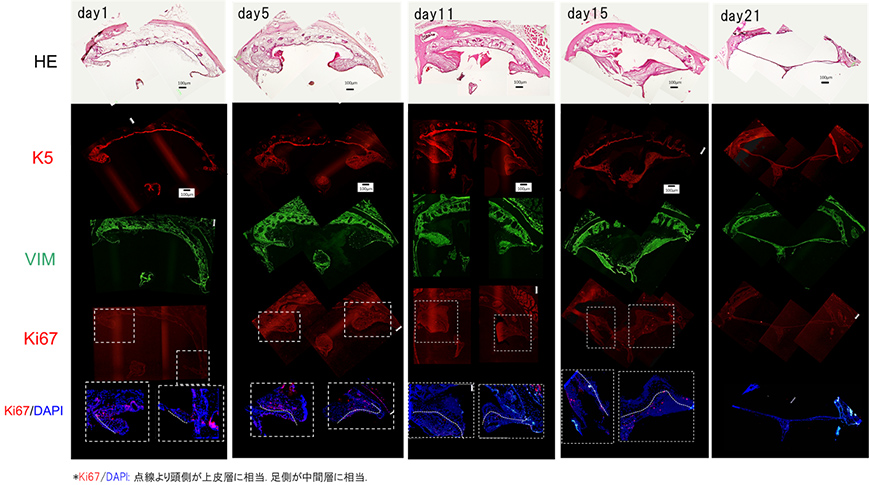
K5: Keratin 5 (marker of epithelial layer), VIM: Vimentin (marker of intermediate layer), Ki67 (marker of proliferation ability)
Dental and Oral Surgery

Research representative
Chief of the Department of Dental and Oral Surgery
TAKAHASHI Katsu
- Research goal
The goal is to develop a treatment that induces tooth eruption by administering a human anti-USAG-1 antibody, a molecular targeted drug against USAG-1.
- Research Theme
- Development of a tooth regeneration therapeutic drug that controls tooth number for the rare disease congenital anodontia.
- background
Congenital tooth loss is considered congenital edentulism, and the condition known as ectodermal dysplasia anhidrotic (EDA) is a rare disease with an incidence rate of 15.8 per 100,000 births. Because patients with congenital edentulism experience edentulism during childhood, when the jawbone is still developing, dentures and dental implants are difficult to use. This condition can lead to oral frailty (a decline in oral function for chewing, swallowing, and speaking) during growth, which can adversely affect nutritional intake and growth. Treatment is limited to replacement teeth using dentures or dental implants after adulthood, and there is a strong desire for the development of tooth regeneration therapy as a radical treatment.
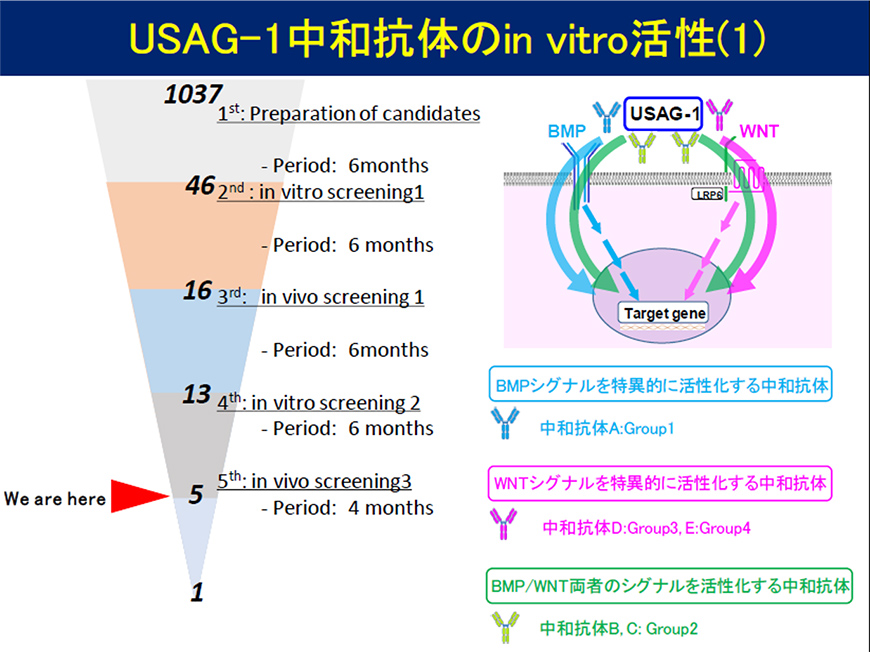
Figure 1
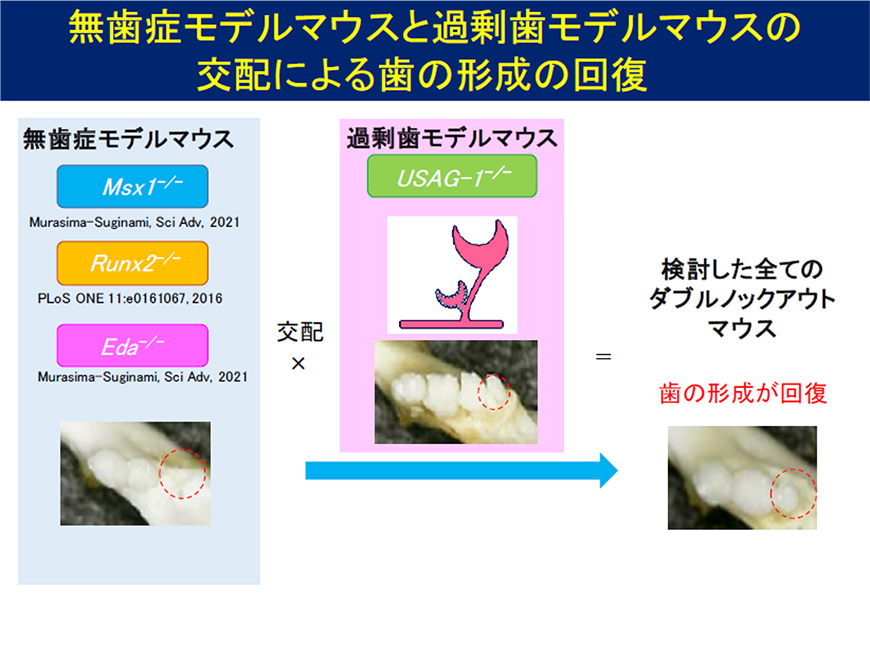
Figure 2
- Research Plan
We found that tooth formation was restored by crossbreeding mice lacking genes such as Eda1, a model of congenital edentulism, with USAG-1 gene-deficient mice, a model of supernumerary teeth (Figure 1). We generated 1,037 neutralizing antibodies targeting USAG-1, and, taking into account differences in their activation patterns for BMP and WNT signaling, as well as differences in antigen recognition sites, narrowed down the list to five neutralizing antibodies, which we acquired intellectual property rights for (Figure 2). We found that a single administration of these antibodies to a mouse model of congenital edentulism restored edentulism (Figure 3). We envision an innovative treatment that regenerates missing teeth with a single administration of human anti-USAG-1 antibodies as a molecularly targeted drug targeting the causative gene mutation (Figure 4).
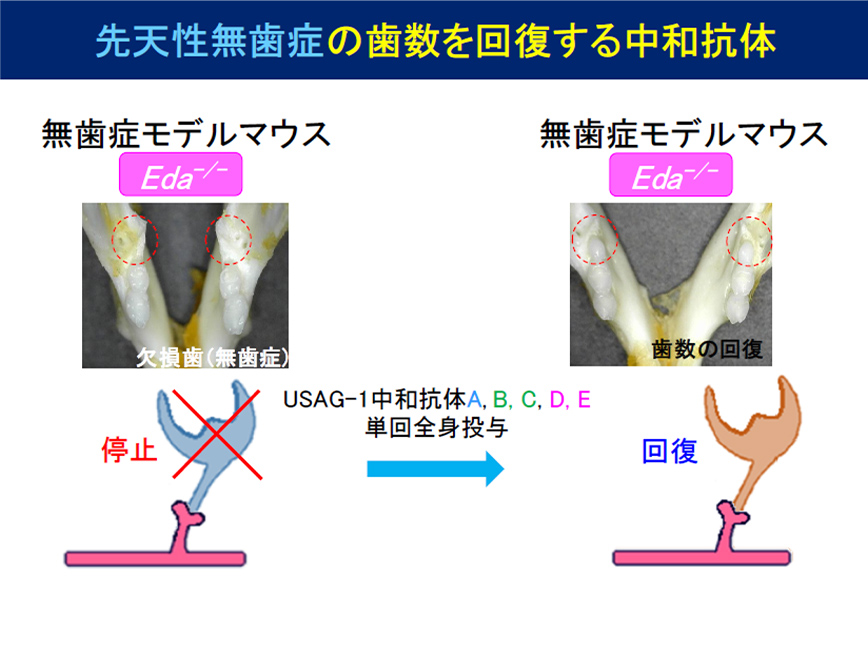
Figure 3
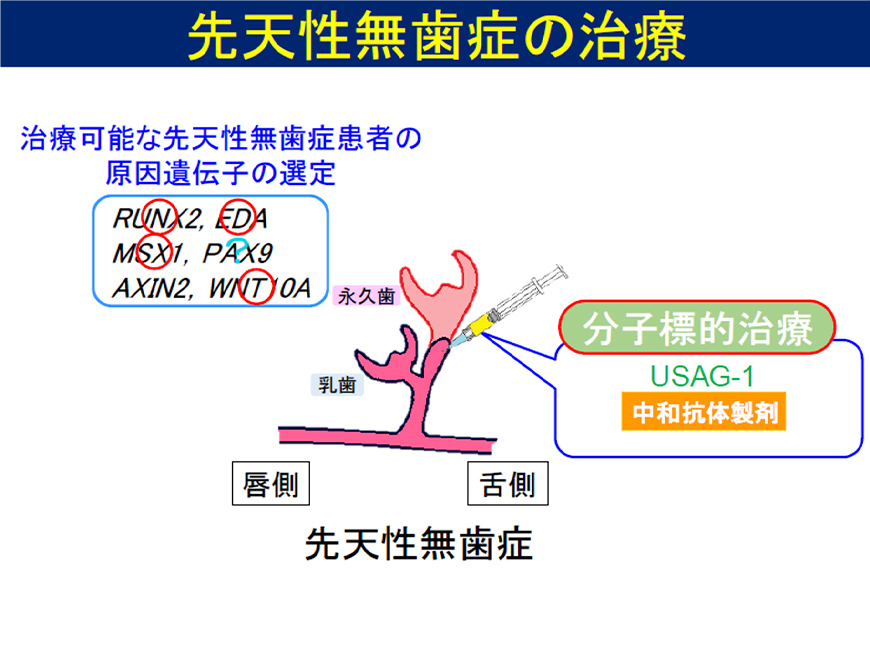
Figure 4
PLoS ONE 11, e0161067. 2016
Inflammation and Regeneration, 40, 21, 2020
Sci Adv, 7, eabf1798, 2021
plastic surgery

Research representative
Department of Plastic Surgery
SUZUKI Yoshihisa
- Research Theme
- Development of nerve regeneration support materials for peripheral nerve injuries
- Research goal
Erectile dysfunction caused by cavernous plexus damage after prostate cancer removal, and urinary problems caused by pelvic plexus damage after uterine or rectal cancer removal, can lead to a decline in quality of life. However, nerve regeneration in these damaged plexuses is considered impossible, and these patients have been left untreated. The purpose of this research is to develop a sheet-type artificial nerve that can also be used to reconstruct defects in the nerve plexus, which forms a complex nerve network. We are currently evaluating its effectiveness in rats using covalently cross-linked alginate.
- Research content
In rats, we have found that erectile dysfunction and urinary dysfunction can be improved by using covalently cross-linked alginate. Currently, we are preparing non-clinical proof-of-concept data and creating a clinical trial protocol under the guidance of the PMDA.
- Research Theme
- Treatment of spinal cord injury with bone marrow-derived mononuclear cells
- Research goal
Regeneration of the central nervous system is difficult, and there is no treatment for spinal cord injury. The purpose of this study is to prove the effectiveness of spinal cord injury treatment using bone marrow-derived cells.
- Research content
We have developed the world's first method for transplanting bone marrow-derived cells into cerebrospinal fluid and have conducted clinical trials. Clinical trials are currently being conducted at our hospital, Shiga University of Medical Science, and Vietnam Da Nang Hospital. Vietnam is a country with a high incidence of spinal cord injuries due to the frequent occurrence of motorcycle accidents and falls. Our first goal is to make this the standard treatment in Vietnam.
respiratory surgery

Research representative
KOU Seiryu
- Research goal
We aim to utilize the results of basic and translational research in clinical practice for lung cancer patients.
- Research Theme
- Biomarker-based personalized chemotherapy
- Research content
The expression of antitumor drug-related biomarkers in lung cancer is evaluated using immunohistochemistry at the Medical Research Institute of Kitano Hospital. For lung cancer with low TS expression, chemotherapy is primarily 5FU or Pemetrexed (Pem), while for lung cancer with low TUBB3 expression, chemotherapy is primarily taxane. It has been shown to be effective as postoperative adjuvant chemotherapy for locally advanced lung cancer.
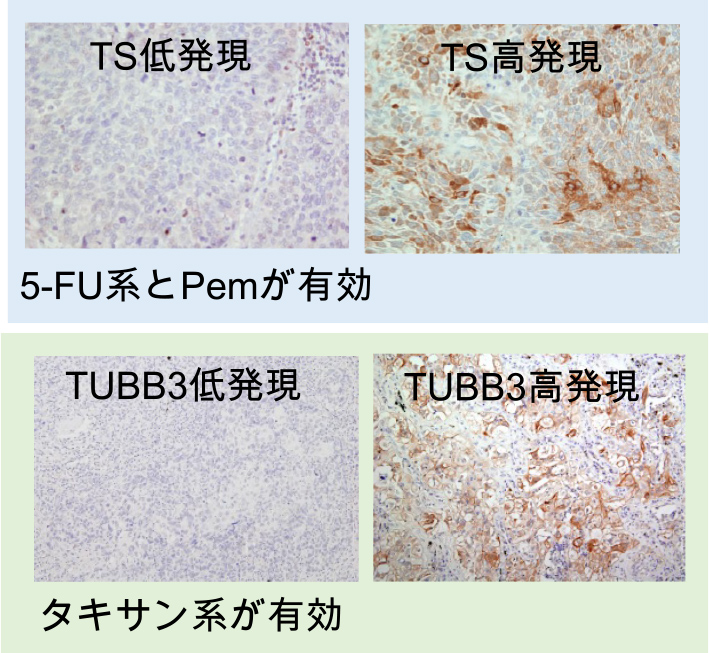
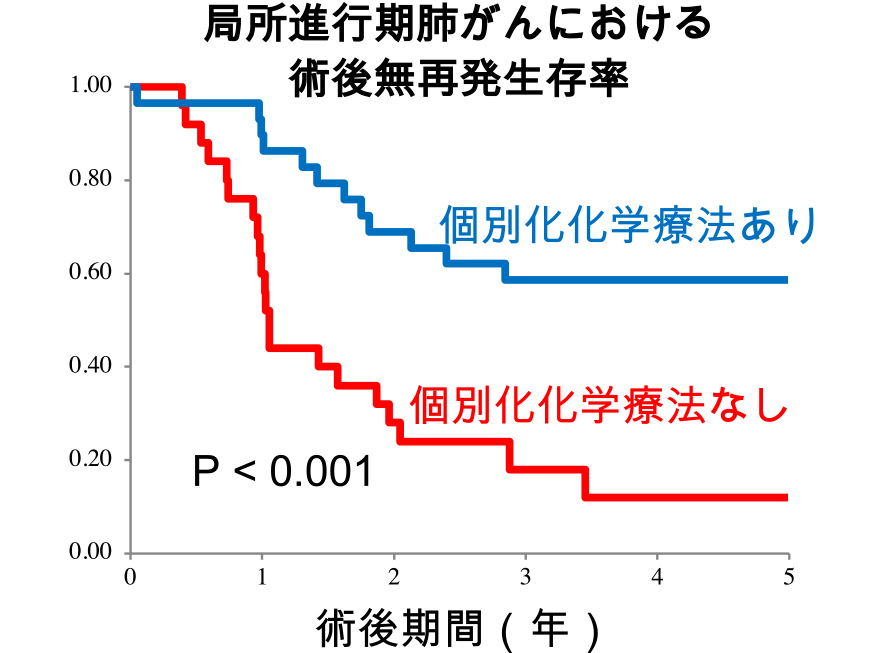
Presented at AACR (American Association for Cancer Research) April 2019.
- Research Theme
- Development of nucleic acid medicine targeting biomarkers
Diabetic endocrinology

Research representative
Director of the Department of Diabetes and Endocrinology, Director of the Department of Endocrinology, Metabolism and Renal Research
HAMASAKI Akihiro

Research representative
Deputy Director of Diabetes Endocrinology and Cadet Researcher Kitano
SHIBUE Kimitaka
researcher
Shoko Honjo
Shiho Ayano
Yohei Seno
Masashi Hasebe
Naoko Takahashi
Mariko Sakai
Research goal
We aim to obtain knowledge that will contribute to elucidating pathology and promoting personalized medicine through detailed physiological testing and molecular-level analysis, starting from questions that arise in the treatment of metabolic and endocrine diseases.
- Research Theme 1
- Study on pancreatic alpha cell function and glucagon action in severe hypoglycemia
- Research content
In the treatment of diabetes, severe hypoglycemia is a highly urgent condition that affects life prognosis, and appropriate treatment and prevention are among our top priorities in daily clinical practice. Recovery from hypoglycemia is known to involve an increase in catecholamines due to activation of the sympathetic nervous system via the central nervous system and glucagon secretion from pancreatic alpha cells. Pathological conditions such as autonomic neuropathy (hypoglycemia-associated autonomic failure (HAAF)) in type 1 diabetes have been studied to determine how the mechanism of recovery from hypoglycemia changes in diabetic patients, but many details of the mechanism remain unclear.
In order to clarify the mechanism of hypoglycemia recovery, we are focusing on glucagon in pancreatic α-cells and attempting to clarify the mechanism of glucagon secretion and how its action is impaired in diabetes by combining clinical specimens and in vitro models.
Our department has archived samples containing various clinical data, including dietary glucagon, and has established an environment for various challenge tests and detailed pathophysiological analysis. By combining these tools, we are attempting to clarify the dynamics of glucagon in diabetic patients with various backgrounds. Furthermore, we will use cell models of the liver, the main target organ of glucagon, to clarify from a molecular biological perspective how glucagon function changes in diabetic patients with specific comorbidities and conditions (obesity, NASH, steroid-induced diabetes, gestational diabetes, adrenal disease, etc.).
Through these studies, we believe that the ultimate mission of our research is to provide safe hypoglycemia prevention and treatment tailored to each individual's condition for diabetic patients with diverse disease backgrounds.
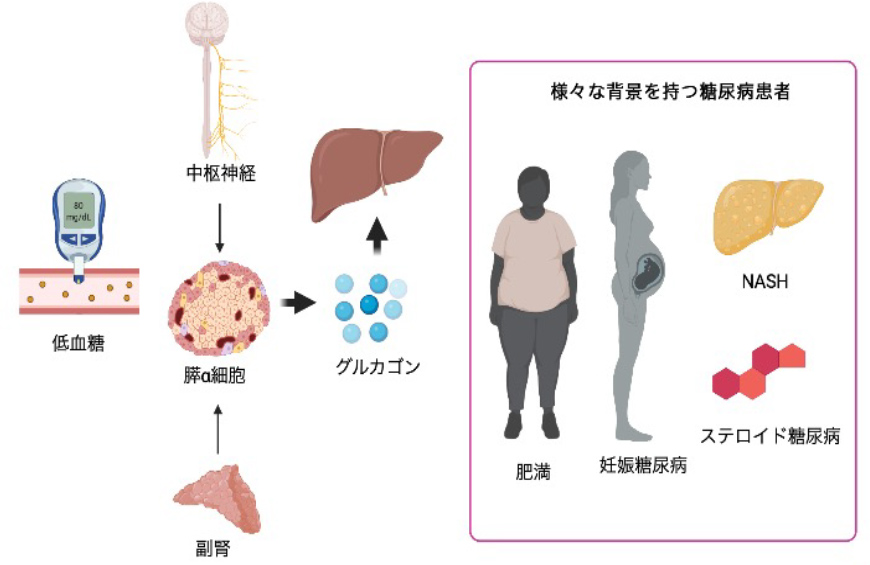
- Research Theme 2
- Discovery of novel biomarkers for metabolic, endocrine, and metabolic diseases
- Research content
Using blood samples and surgical specimens from patients with metabolic endocrine disorders, we measure gastrointestinal environmental factors such as incretins and perform transcriptome analysis. We are exploring new biomarkers that will promote personalized medicine for diabetes and the diagnosis of functional endocrine tumors.
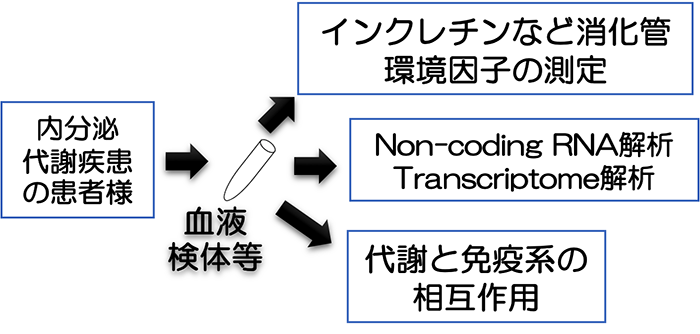
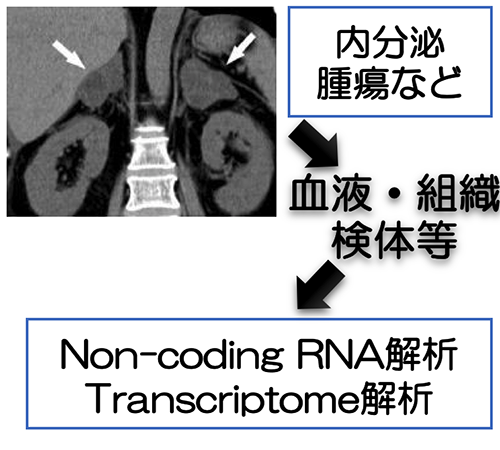
- Research Theme 3
- Genetic analysis of metabolic and endocrine disorders
- Research content
We are currently working to establish a genetic diagnostic system for hereditary metabolic and endocrine disorders.
- Target diseases
Hereditary calcium metabolism disorders, hereditary endocrine tumors, etc.

Research representative
Deputy Director of Diabetes Endocrinology
IZUMI Ryota
Research goal
We aim to establish better diabetes treatments by elucidating the multifaceted actions of incretins.
- About incretins
Incretins are hormones secreted from the intestinal tract, and there are two known types of hormones: GIP (glucose-dependent insulinotropic polypeptide) and GLP-1 (glucagon-like peptide-1). Both have been reported to promote insulin secretion. Drugs related to these incretins are primarily used as antidiabetic and anti-obesity drugs, but they are also believed to have pleiotropic effects. Diabetic treatment requires not only lowering blood glucose but also comprehensive management of complications. Therefore, the existence of favorable pleiotropic effects provides a new justification for their positioning as drugs suitable for diabetes treatment.
- Research content
 We are currently analyzing the changes that occur with the administration of incretin-related drugs through experiments primarily using rats. In addition, by comparing data from patients who have actually been administered incretin-related drugs, we will examine whether the findings from animal experiments can be applied to humans. Furthermore, by searching for drugs that further enhance these effects, we aim to establish a more comprehensive diabetes treatment method.
We are currently analyzing the changes that occur with the administration of incretin-related drugs through experiments primarily using rats. In addition, by comparing data from patients who have actually been administered incretin-related drugs, we will examine whether the findings from animal experiments can be applied to humans. Furthermore, by searching for drugs that further enhance these effects, we aim to establish a more comprehensive diabetes treatment method.
Nephrology

Research representative
Deputy Chief of Nephrology
HANDA Takaya
Purpose/Prospect
Our goal is to conduct research that bridges research and clinical practice, something only doctors who are constantly in contact with patients in clinical settings can do, and to provide information that will be useful in treating patients with chronic kidney disease.
- Pathological analysis and prognosis using a renal biopsy database
Our department maintains a kidney biopsy database and biobank of over 2,000 cases. Compared to IgA nephropathy, the most common type of chronic glomerulonephritis, we have demonstrated that IgA-dominant IRGN, a similar disease that is expected to increase with aging, has a high number of inflammatory cells in the glomerulus and IgA deposition in the glomerular wall, resulting in poor renal and life prognosis. We use the medical information and biobank of consenting patients to evaluate their background, pathological analysis, and prognosis, and evaluate new biomarkers.
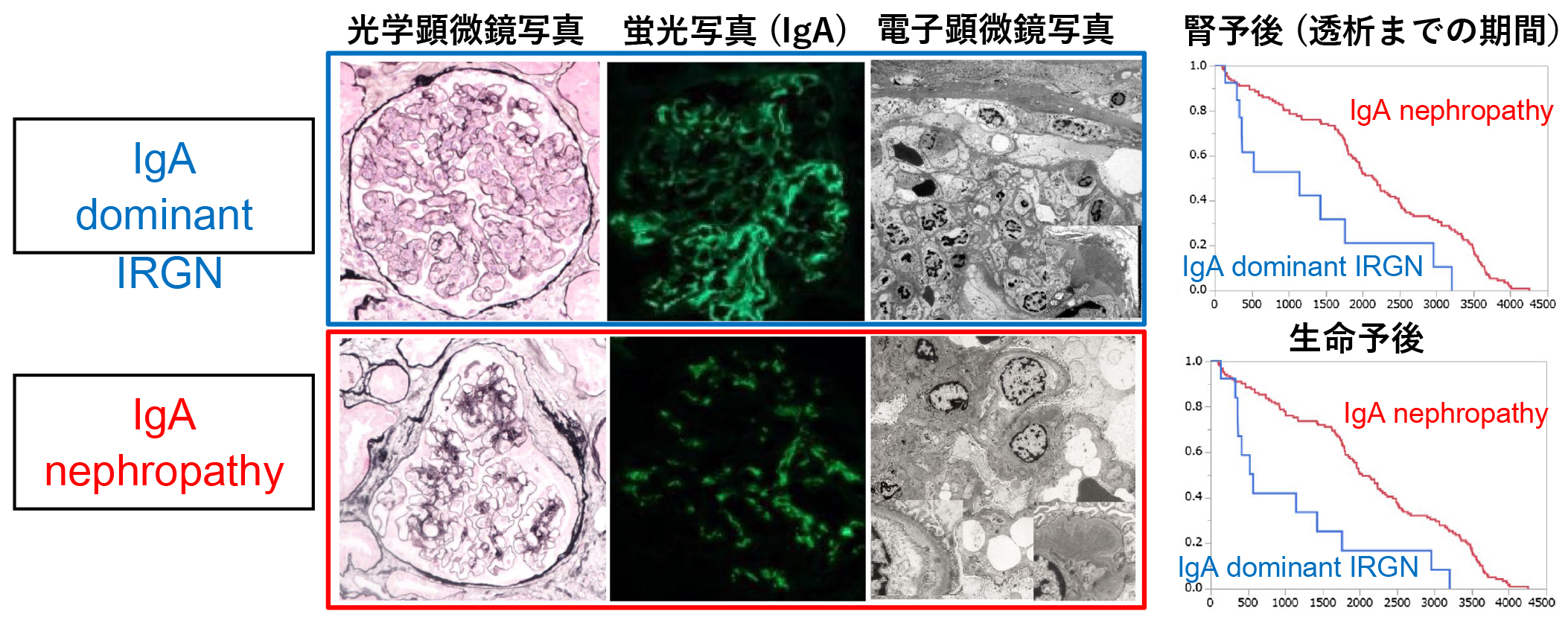
Takaya Handa et al. Clin Exp Nephrol. 2018 Oct;22(5):1116-1127
- Evaluation of cytokines in novel apheresis treatments
Comprehensive severe chronic lower limb ischemia is a chronic ischemic disease that can sometimes lead to lower limb amputation, and Leocana® is known as a novel apheresis treatment. We have shown that the therapeutic effect of Leocana® and increases in blood cytokine (bradykinin) levels correlate with changes in blood pressure. We will continue to evaluate humoral factors and prognosis following apheresis treatment.
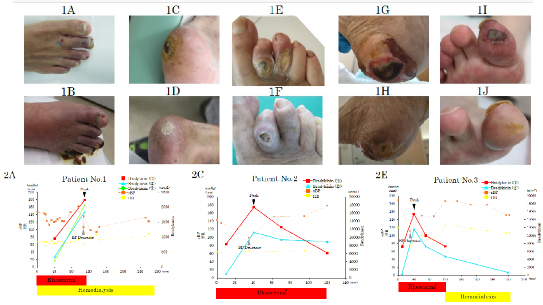
Takaya Handa et al.Ther Apher Dial. 2024 Jan 3.
Gastroenterology

Research representative
Gastroenterology
MORITA Toshihiro
- Research goal
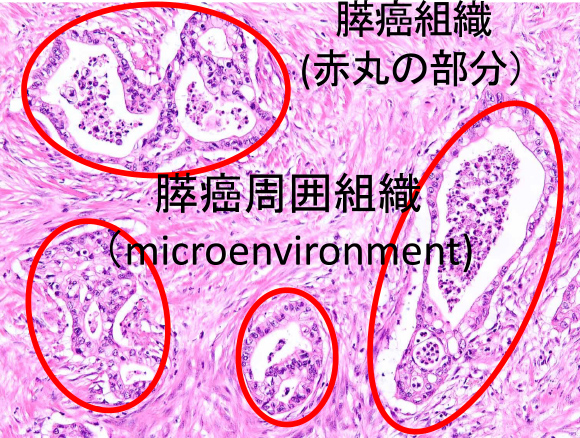
Discover new biomarkers for pancreatic cancer. Clarify the mechanisms underlying the formation of pancreatic cancer and its surrounding tissues (microenvironment).
- Research Theme 1
- Search for new biomarkers in early stage pancreatic cancer and analysis of the mechanisms underlying the formation of pancreatic cancer and its surrounding tissues (microenvironment)
- background
Pancreatic cancer is an extremely difficult disease to treat, with a five-year survival rate of less than 10%, and early detection is essential to improving prognosis. Pancreatic cancer is characterized by severe fibrosis and neovascularization in the surrounding area (microenvironment), and detecting pancreatic atrophy due to fibrosis may lead to early detection.
miRNA is a type of RNA that regulates gene expression and is known to be secreted by pancreatic cancer and surrounding tissues.
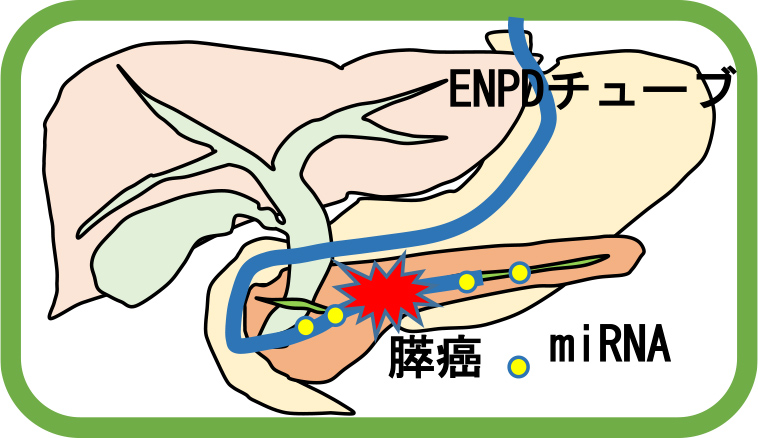
Capturing miRNAs secreted into pancreatic juice from pancreatic cancer and surrounding tissues may provide new biomarkers for early-stage pancreatic cancer and may help elucidate the mechanism by which pancreatic cancer develops.
- Research Plan
For patients suspected of early-stage pancreatic cancer due to pancreatic duct stricture, atrophy, or fibrosis of the pancreatic parenchyma, we perform endoscopic examinations and place pancreatic duct drainage tubes (ENPD tubes). At this time, we collect pancreatic juice, measure the miRNAs in the juice, and compare them with those of healthy individuals to search for miRNAs that could be new biomarker candidates.
Furthermore, we will elucidate the mechanisms underlying the formation of pancreatic cancer and surrounding tissues by analyzing the functions of candidate miRNAs using cell lines and experimental animals.
Rheumatology and Collagen Diseases

Research representative
TAKAHASHI Reiko
- Research goal
Elucidating the pathology of systemic lupus erythematosus (SLE), an autoimmune disease in which the pathology is formed through complex, sequential interactions of multiple factors, and exploring "immunological remission"
- Research Theme 1
- Identification of factors such as SOCS1 (Suppressor of cytokine signaling 1) that contribute to the stable maintenance of SLE pathology and elucidation of their roles
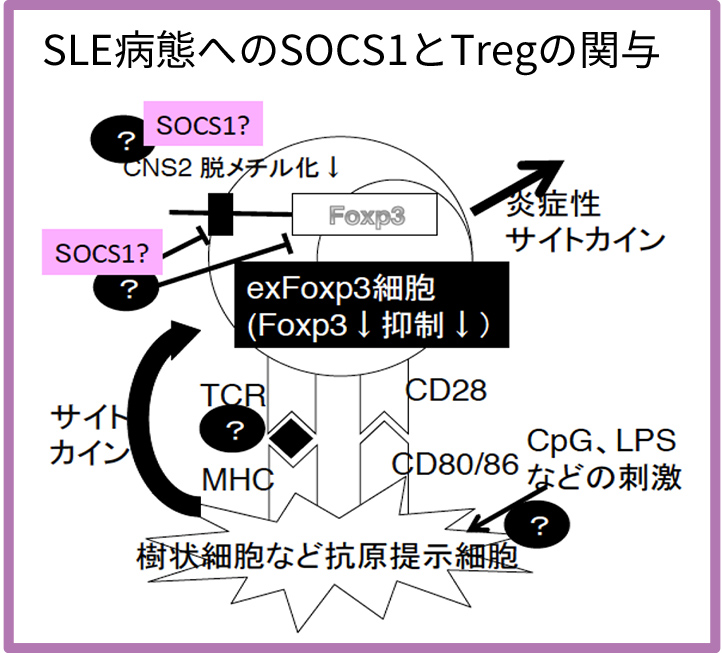 background
background
The representative has elucidated the role of SOCS1 in maintaining suppressive function through plastic defense in regulatory T cells (Treg) (Takahashi R JEM 2011, Takahashi R J. Immunol.2017). Based on these findings, we will further advance research into the involvement of SOCS1 in SLE pathology and develop methods to prevent relapse and maintain stable SLE pathology.- Research Plan
- Using patient blood and biopsy tissues, we will analyze the time course of SLE activity and SOCS1 expression dynamics, the correlation between symptom severity and SOCS1 expression levels, and the regulatory mechanism of SOCS1 expression in SLE patients.
- Using SOCS1-deficient or SOCS1-transgenic mice, we will analyze the expression dynamics of SOCS1, which contributes to the stabilization of SLE pathology.
- In addition to SOCS1, we will identify molecules that maintain the immunological balance in SLE and analyze their roles.
- References
Takahashi R, Nakatsukasa H, Shiozawa S, Yoshimura A. SOCS1 Is a Key Molecule That Prevents Regulatory T Cell Plasticity under Inflammatory Conditions.
J Immunol. 2017;199:149-158.
Takahashi R, Nishimoto S, Muto G, Sekiya T, Tamiya T, Kimura A, Morita R, Asakawa M, Chinen T, Yoshimura A.
SOCS1 is essential for regulatory T cell functions by preventing loss of Foxp3 expression as well as IFNg and IL-17A production.
J Exp Med. 2011;208:2055-67.
- Research Theme 2
- Elucidation of the dynamics of cytokine-related molecules that regulate the disruption or stable maintenance of immunological equilibrium in SLE
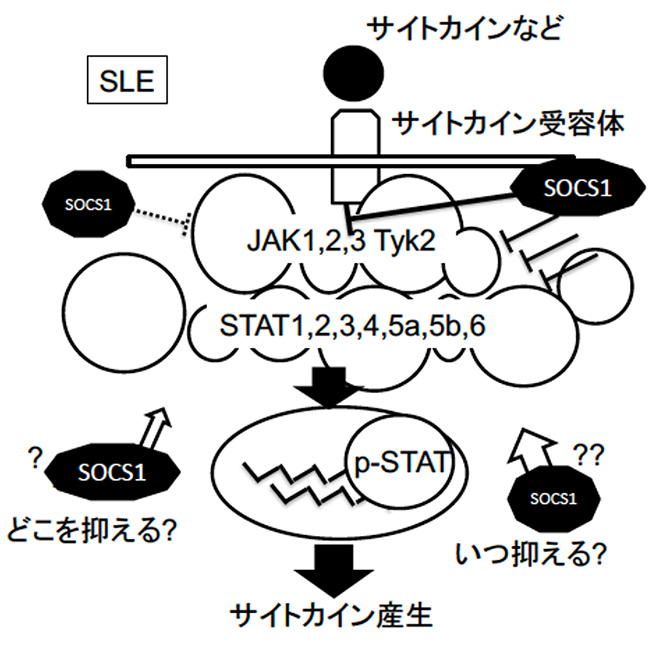 background
background
The control of cytokine molecular networks by inhibitory molecules such as SOCS1 is complex, and the full picture of how they are regulated has not yet been elucidated (Yamada et al., Int Immunol (2006)). Furthermore, it is unclear how these cytokine networks are regulated in the pathology of SLE patients, or how these networks can be regulated to control SLE pathology. By elucidating the dynamics of cytokine-related molecules, we will be able to not only stabilize and maintain SLE pathology, but also develop measures to prevent the onset of infections and malignant tumors through the administration of rationally optimal immunosuppression.
- Research Plan
We will perform quantitative analysis of cytokine-related gene and protein expression using peripheral blood samples from SLE patients. We will analyze how these conditions change during the healing process of SLE patients, as well as their relationship to the pathology, and use statistical analysis to identify important molecules and pathways.
- Summary
The "balance between positive and negative" is important in immunological events. Among the problems that must be overcome in controlling the pathology of SLE patients, we will focus on the following two points: 1) the search for treatment methods that prevent relapse in order to prevent the onset of irreversible organ lesions, and 2) the search for treatment methods that prevent the onset of infections and malignant tumors caused by non-specific treatment. Achieving our goals requires an accurate understanding of this balance. Based on these findings, we will explore what "immunological remission" in SLE is and elucidate how SLE pathology should be controlled.
- Features
The representative has been involved in the treatment of many SLE patients at various facilities across the country. Going forward, he will continue to devote himself to research to clarify the etiology of SLE, based on the insights and questions he encounters in his daily medical practice. Furthermore, as a hospital and research institute with many SLE patients, he will particularly focus on research using patient samples. He hopes that in the future he will be able to clearly explain the causes of SLE and other collagen diseases to patients.
Gastrointestinal surgery

Research representative
Gastrointestinal surgery
IGUCHI Kota
- Research Theme
- Mass spectrometry-based biomarker research for liver disease
- Research goal
Our ultimate goal is to utilize the biomarkers extracted through basic and clinical research in the treatment of patients.
- Research content ①
It plays a central role in the treatment of liver cancer and metastatic liver cancer.liver resectionLiver resection has become safer due to improvements in techniques, but for patients with poor liver function or those who need to have a large amount of liver resection,Liver failureIn a rat hepatectomy model, what is the critical point or threshold between animals that undergo liver regeneration after hepatectomy and animals that fail to regenerate and die of liver failure?Liver metabolome (metabolites)We are exploring this from the perspective of:
- Research content ②
With the Westernization of dietary habits, metabolic syndrome, characterized by obesity, lipid metabolism disorders, and hypertension, has been attracting attention as a cause of liver cancer.A pig carcinogenesis model in the setting of nonalcoholic steatohepatitis (NASH)Using this pig model, we are analyzing the blood and liver proteome (proteins) and extracting biomarkers for the time course of normal liver, fatty liver, NASH, cirrhosis, and carcinogenesis.
- Features
In a porcine NASH liver cancer model, ITIH-4 was extracted as a protein that showed significant changes in serum two-dimensional electrophoresis. ITIH-4 has also been confirmed to be valid as a marker related to patient prognosis in clinical practice.
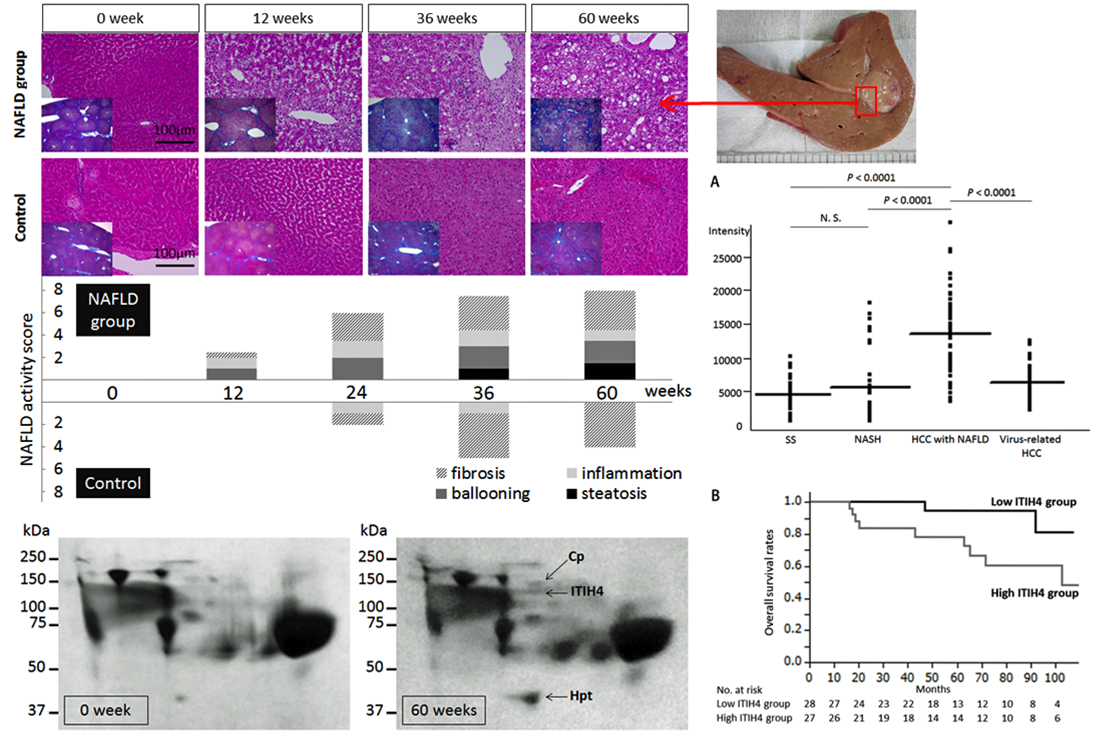
AASLD 2016 presentation Manuscript in submission(Nakamura et al)

Research representative
Visiting Researcher, Oncology Research Department
YAMAMOTO Takehito
the goal
We are conducting basic research using genetic data obtained from cultured cancer cells so that patients with colorectal cancer can receive the latest unapproved anticancer drugs.
- Application of technology to culture colon cancer cells
We are conducting research using a technique to culture cancer cells in a special form called "cancer stem cell spheroids" using colon cancer tissue removed by surgery. This method allows us to diagnose whether an anti-cancer drug will be effective before administering it to the patient, and to analyze genetic data to accurately determine the type of cancer. In addition, we can transplant the spheroids into mice and administer anti-cancer drugs to determine their effectiveness, making this a method with a wide range of applications.
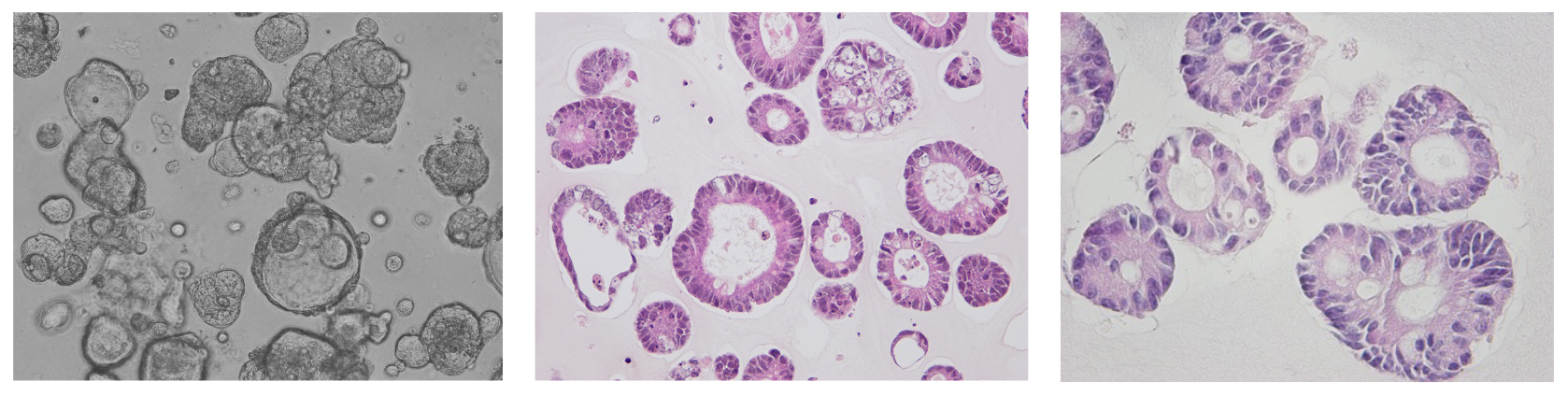
Yamaura T, Yamamoto T et al. Oncotarget. 2018, Miyoshi H et al. Oncotarget. 2018
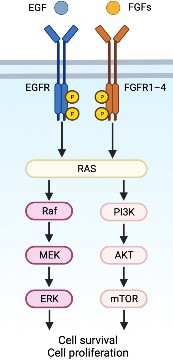
- Clinical application of new anti-cancer drugs, FGFR inhibitors
FGFR (fibroblast growth factor receptor), which is found on the surface of cancer cells, is an important protein involved in the proliferation of cancer cells. FGFR inhibitors, a new molecular targeted therapy, can suppress the proliferation of cancer cells by blocking this protein. Currently, they are used for bladder cancer, biliary tract cancer, etc., but have not yet been approved for colorectal cancer. We aim to develop a method to accurately diagnose which patients are likely to respond to FGFR inhibitors, and to apply FGFR inhibitors clinically to colorectal cancer patients.
Kitano S, Yamamoto T, et al. Cancer Science 2022 Yamamoto T, et al. Cancers 2020

Research representative
Visiting Researcher, Oncology Research Department, Kitano Cadet Mentor
Lecturer, Department of Hepato-Biliary-Pancreatic and Transplant Surgery, Kyoto University
UCHIDA Yoichiro
- Research Theme
- Overcoming Ischemia and Reperfusion Injury (IRI)
IRI is caused by reduced blood flow and subsequent reperfusion of blood and is a significant problem in all human organs.
- Research goal
Our group aims to overcome hepatic IRI in liver surgery (hepatic resection/liver transplantation, etc.) by elucidating its mechanisms, developing treatments, and applying them to clinical practice.
- Research system
Since 2012, our research group (Digestive Surgery) has established a collaborative graduate school system with the Kyoto University Department of Frontier and International Medicine (Visiting Professor Hiroaki Terashima/Chief of the Department of Digestive Surgery).
We are conducting research together with graduate students from the Department of Hepato-Biliary-Pancreatic and Transplant Surgery at Kyoto University (four medical doctorates have been awarded: Hirao Hiroshi (studying abroad at UCLA), Kadono Kentaro (studying abroad at UCLA), Miyauchi Tomoyuki (visiting researcher), and Kawazoe Junya (visiting researcher). Research is currently being conducted primarily by Saga Kenichi (graduate student), Tanaka Kosuke (graduate student), and Kawamoto Hiroshi (visiting researcher).
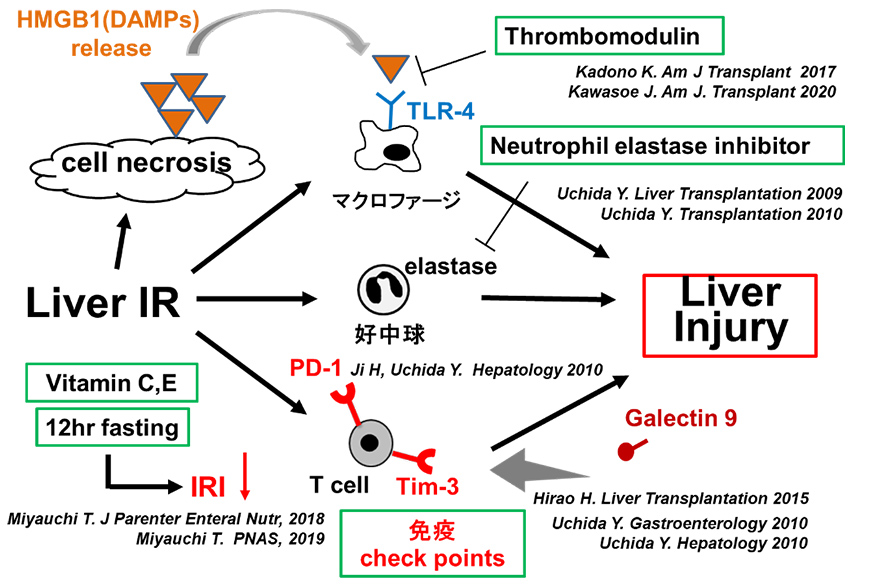
Cells and molecules involved in hepatic IRI and the IRI suppression methods we have reported
- Current knowledge and prospects
We discovered that a very simple, short-term dietary restriction called "fasting" is effective in overcoming hepatic IRI (improving liver surgery outcomes) (Ketone bodies (β-hydroxybutyrate) are important: 2019 PNAS).
We are conducting analyses of biological changes caused by dietary restriction (metabolome analysis), effects on the digestive tract (fecal microbiota metagenomic analysis), and circadian rhythms (clock genes) to elucidate the endogenous molecular mechanisms of the "positive effects of dietary restriction." We aim to discover and establish "optimal perioperative dietary therapy" and drug (molecule) seeds that alleviate liver damage.
-

↑Research introduction click
He is a surgeon with highly skilled and highly skilled surgical techniques, trusted by his patients, and always passionate about elucidating diseases and developing new treatments. He is dedicated to both clinical practice and research with the goal of becoming an "academic surgeon."
Impact, 2019
Hematology

Research representative
Visiting Researcher, Oncology Research Department
Department of Hematology, Kyoto University
INANO Shojiro
- Research goal
We aim to create a new platform for cancer treatment.
- Research Theme 1
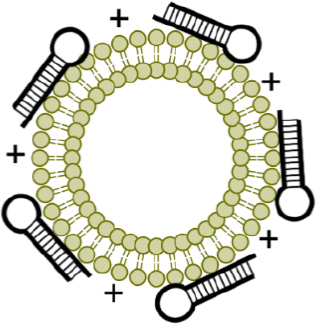
- Development of exosome-mediated therapies
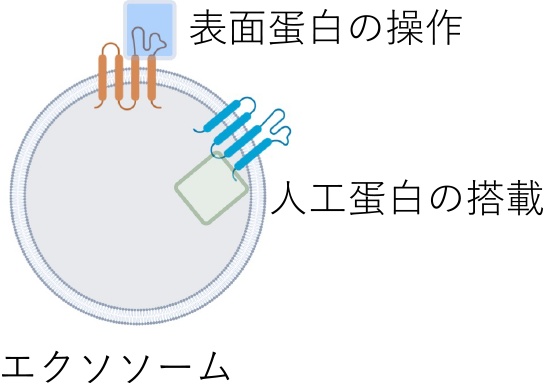 Exosomes are small particles with a diameter of about 100 nm that are secreted by cells, but they are known to play a major role in intercellular communication and are attracting attention in the field of treatment. We are conducting research to enable more cancer-specific treatment by manipulating the surface proteins of exosomes and loading them with therapeutic proteins.
Exosomes are small particles with a diameter of about 100 nm that are secreted by cells, but they are known to play a major role in intercellular communication and are attracting attention in the field of treatment. We are conducting research to enable more cancer-specific treatment by manipulating the surface proteins of exosomes and loading them with therapeutic proteins.
- Research Theme 2
- Development of artificial proteins that degrade cancer-causing proteins
- Currently, many therapeutic drugs called PROTACs are under development, which degrade target proteins. While these drugs are innovative, unfortunately, many of them are difficult to target. Therefore, we have used artificial proteins to achieve the degradation of cancer treatment targets that are difficult to achieve with conventional approaches, such as KRAS and β-catenin. This technology can also be used in neurodegenerative diseases where abnormal proteins accumulate, and we aim to apply it to clinical use beyond cancer.
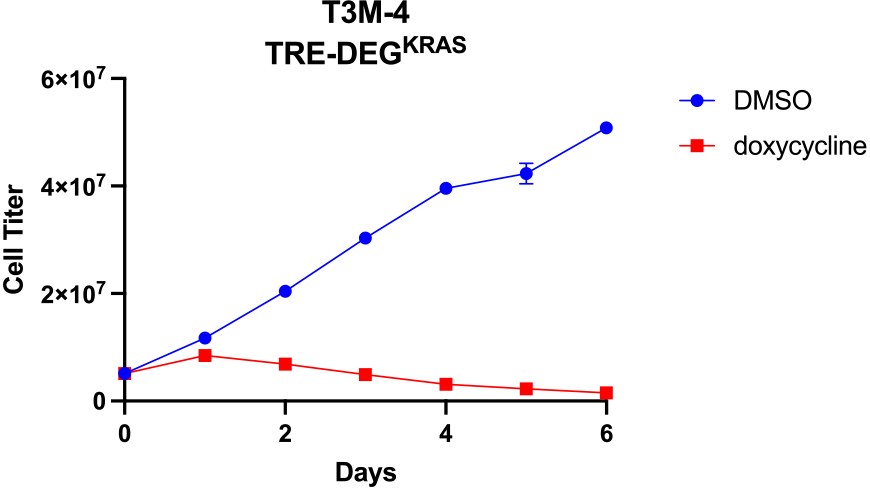
When activated KRAS degrading protein is expressed in the pancreatic cancer cell line T3M-4, extremely strong growth inhibition is observed.



















 We are currently analyzing the changes that occur with the administration of incretin-related drugs through experiments primarily using rats. In addition, by comparing data from patients who have actually been administered incretin-related drugs, we will examine whether the findings from animal experiments can be applied to humans. Furthermore, by searching for drugs that further enhance these effects, we aim to establish a more comprehensive diabetes treatment method.
We are currently analyzing the changes that occur with the administration of incretin-related drugs through experiments primarily using rats. In addition, by comparing data from patients who have actually been administered incretin-related drugs, we will examine whether the findings from animal experiments can be applied to humans. Furthermore, by searching for drugs that further enhance these effects, we aim to establish a more comprehensive diabetes treatment method.






 background
background background
background








